Август 11th, 2013
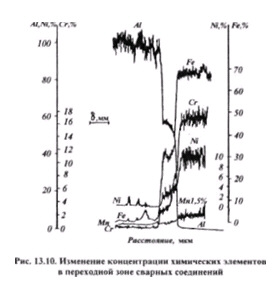
Пленка, обогащенная окислами хрома, по-видимому, в сочетании с адсорбционным слоем сообщает железным сплавам наилучшие защитные свойства.Электрохимическая коррозия металлов и сплавов, имеющая место в растворах, есть процесс электрохимического окисления, т. е. сопровождающегося нарушением электрической нейтральности и возникновением скачка потенциала на границе металл — раствор. Ионы металла частично выходят из кристаллической решетки в жидкую фазу, так как это приводит к уменьшению свободной энергии системы. Отно сительной характеристикой изменения свободной энергии при окисле-кии разных металлов, а следовательно, и их термодинамической устойчивости могут служить значения нормального или стандартного электродного потенциала, который представляет собой равновесный потенциал металла при активности его собственных ионов в растворе, равной единице. В табл. 101 [197, 778] приведены для некоторых металлов значения стандартного потенциала по водородной шкале, при которой потенциал водородного электрода принимается за нуль. Для металлов, склонных к пассивированию, потенциалы соответствуют их активному состоянию.При достижении равновесного потенциала, соответствующего минимуму свободной энергии системы, процесс окисления металла должен был бы прекратиться. Однако равновесный потенциал не достигается, и процесс электрохимической коррозии продолжается, если одновременно с окислительным или анодным процессом протекает восстановительный или катодный процесс (катодная деполяризация). Последний может заключаться в восстановлении многих веществ [см. 778, табл. 2], в частности содержащихся в растворе ионов другого металла пли кислорода. Необходимым условием для этого является отрицательное суммарное изменение свободной энергии системы, т. е. восстанавливаемый металл должен иметь более положительный равновесный потенциал, чем растворяющийся (при процессе восстановления следует взять знак потенциала, обратный приведенному в табл. 111 для процесса окисления).
